Неважно сколько стоит телефон. Он всегда работает от батареи. Как же она заряжается? Давайте посмотрим, как батарейка заставляет работать
устройство. Причина в том, что аккумуляторы могут вырабатывать ток.
Под током обычно понимается положительный ток. Он имеет направленность от плюса к минусу. На самом деле все дело в отрицательно заряженных электронах. Которые бегут от отрицательного заряда аккумулятора к положительному.
Так почему же батарейка работает?
Что запускает процесс движения электронов? Давайте посмотрим, откуда взялась батарея. Мы возьмем стакан воды и начнет увеличивать изображение. Вода состоит из молекул. Один атом кислорода и два атома водорода. Увеличиваем масштаб атома водорода! В центре находится ядро.

Ядро атома содержит протоны. Протон заряжен положительно. Атомы и все вокруг имеют положительный заряд. Вокруг ядра атома есть электронные облака, или орбитали. В них движутся электроны с отрицательным зарядом, о которых говорилось ранее.
Схематично эту структуру изображают кругами. Плюсиком в круге изображают количество
положительно заряженных протонов. Внешний край представляет собой слой электронов. Атом имеем равное количество положительных и отрицательных частиц. С движением электронов связана работа батареи.
Откуда электроны в батарее?
У большинства элементов в естественной среде нет электричества. НО! Атомы разных веществ имеют разное количество электронных оболочек вокруг ядра. У некоторых три оболочки вокруг ядра.

Медь - особенный элемент, имеет четыре электроннных оболочки. Крайние электроны стремятся оторваться от атома меди и улететь в виде свободных электронов.
Когда мы электризуем медь, это уже очень маленькая электростанция.
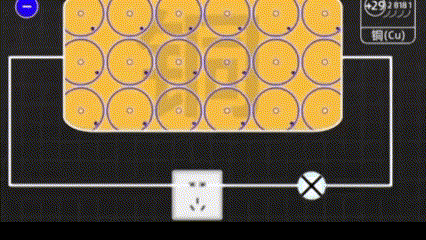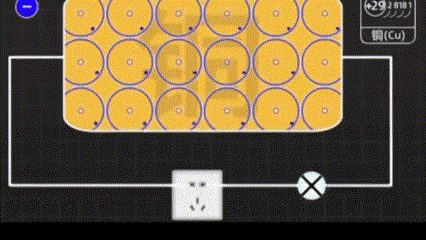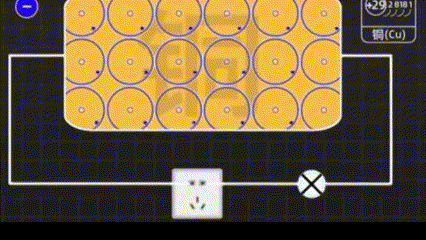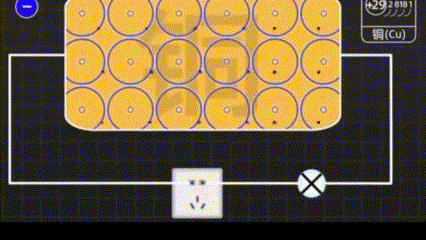
Магнит притягивает электроны, чтобы они двигались в нужном направлении.
С помощью меди легче управлять электронами.
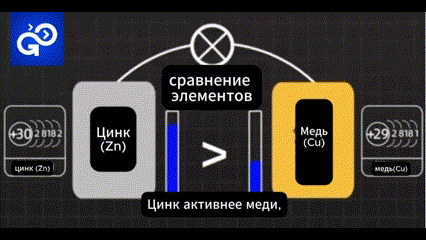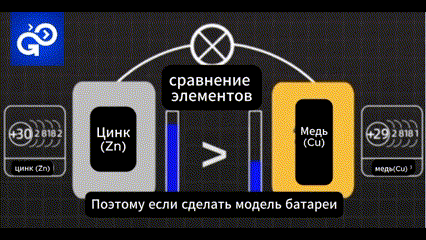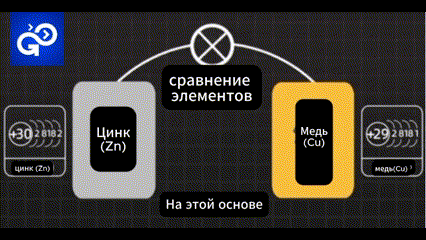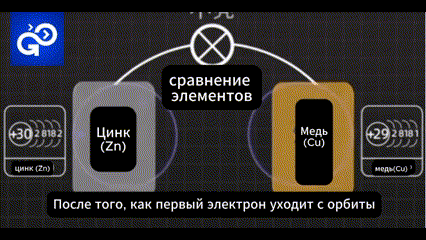
Цинк активнее меди, легче теряет электроны.
Поэтому если сделать модель батареи на этой основе. Можно ли получить поток электричества?
Не совсем. После того, как первый электрон уходит с орбиты атом остается заряженным отрицательно.
Количество электронов становится меньше, чем количество протонов. Поэтому атом цинка будет заряжен положительно.
И тот же атом будет стараться притянуть электрон на место выбывшего. Если у меди достаточно электронов на орбите, то она будет отталкивать электрон.
У меди нет больше места для свободного электрона, и он вернулся к цинку. Так что эта модель батареи не работает.

Так каково же решение? Давайте сначала посмотрим на структуру атома.
Цинк имеет 2 электрона на внешней оболочке. И когда электроны покидают атом. Оставшаяся часть атома становится "ионом". Атом цинка в этот момент положительный. Это новые ионы. Таким образом, на каждые два электрона, которые покидают цинк. Цинк выбрасывает ион.
Чтобы основная масса вещества оставалась электрически нейтральной.
За каждый полученный электрон, добавляется новый положительно заряженный ион меди.
Ёмкость, где идет соединение, также является электрически нейтральной.
Метод очень прост. Положите оба куска металла в солевой раствор.
Электроны быстро бегут от цинка к меди. Образовавшийся новый ион выходит в рассол.
Лишние электроны из меди также переходят в рассол.
Происходит химическая реакция в результате которой образуется газ, оседает осадок. Это называется электролит.

Весь процесс создает поток электронов с направленным движением. Который создает электричество и заставляет работать приборы. Эта простая модель батарейки.
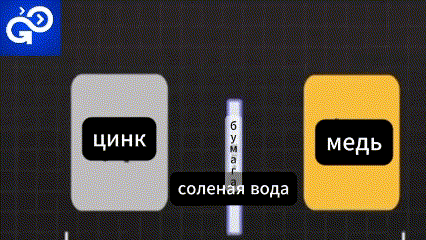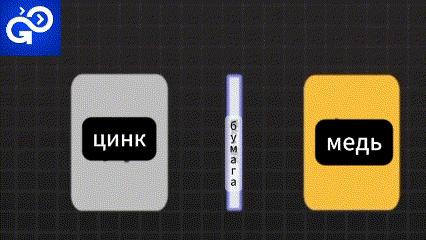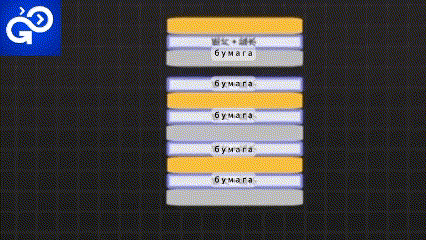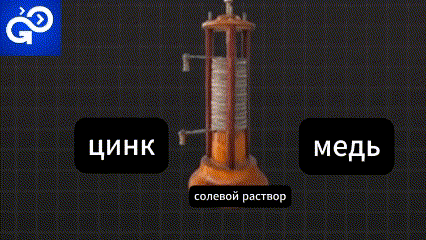
Исторически первые батарейки были сделаны из листов бумаги, смоченных в рассоле. Затем их помещали между металлами и продолжали добавлять слои снова и снова. Это первая в мире батарейка - «Вольтов столб».
Но самый большой недостаток этой батареи. Ее можно разрядить только один раз.
Существует ли батарея, которую можно перезаряжать?
«Вольтов столб».
Первая перезаряжаемая батарея была изобретена
в 1859 году Гастоном Планте.

Он использовал два кусочка свинца в серной кислоте.
И пропускал через них электрический ток.
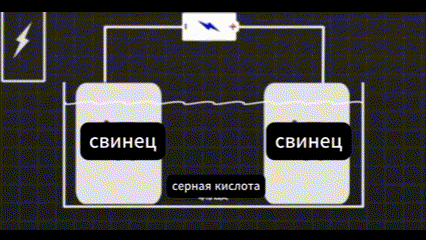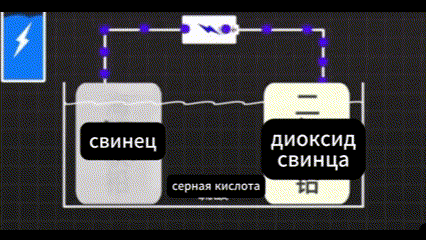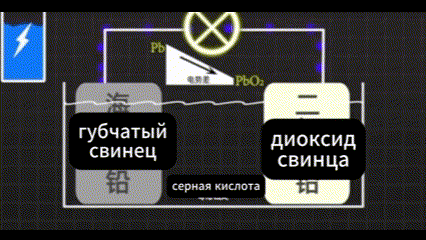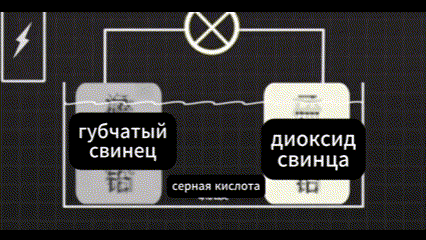
Он обнаружил, что одна сторона окисляется до диоксида свинца. Свинец с другой стороны превратился в губчатый свинец. Между двумя сторонами свинца существует очень большая разница в напряжении.
Электроны могут двигаться направленно.
Самое удивительное, что после того, как электроны исчезнут.
То есть, когда энергия будет сброшена, весь свинец вернется в свое первоначальное состояние.
То есть, когда энергия будет сброшена, весь свинец вернется в свое первоначальное состояние.
Необходимость в зарядке. Весь этот процесс происходит в свинцово-кислотном аккумуляторе.

Хотя свинцово-кислотном аккумуляторы и перезаряжаемые, но недостатком является то, что они слишком большие и тяжелые.
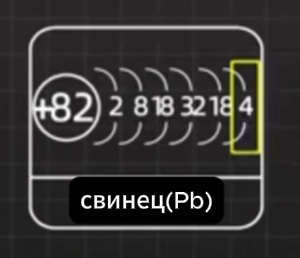
Это происходит потому, что свинец очень плотный: он имеет 82 протона
Но доступны только крайние 4 электрона:
Какие же еще вещества подходят для батареек?
Подходящее вещество должно иметь как можно меньшую массу ядра и в то же время иметь сильную склонность к потере
электронов.
Какие элементы лучше всего подходят? Один из лучших кандидатов - литий (Li). У Li всего три протона. И он очень активен и он теряет электроны очень легко .
При той же плотности энергии. объем лития может быть во много раз меньше свинца.
Но дело в том, что Li слишком активен. Он вступает в реакцию с водой и кислородом.
Например, когда электроны уходят во время разряда. И в то же время выбрасываются ионы. Но при зарядке их трудно вернуть обратно.
Литий кристаллизуется и становится мертвым.
Поэтому блочная литиевая структура для перезаряжаемых батареек не подойдет

В литиевых батареях используется Технология встраиваемых соединений.
Например, при разрядке внешние ионы могут быть встроены внутрь. Внешние ионы могут быть встроены внутрь.
Не происходит расширения и деформации элемента.
Поэтому, основываясь на этом принципе нужно два материала. Один положительный, второй - отрицательный. Положительный электрод изготовливают
из фосфата железа. Или тройного материала легированного марганцем. А отрицательный электрон - графит. Эти два материала будут отвечать за проводимость в металлической жидкости.
В центре находится диафрагма, которая пропускает только ионы. А затем он помещается в электролит.
Теперь давайте соединим провода и покажем, как это работает. Сначала этап зарядки. Положительные электроны бегут по проводу к отрицательному электроду. А положительные ионы попадают в электролит.


